-
平衡电位 编辑
平衡电位(equilibrium potential)指静息条件下细胞膜内外的电位差。细胞膜内外的钾离子浓度内高外低,存在浓度梯度,而细胞膜可允许钾离子透出膜外。当钾离子外移开始时,使钾离子外移的膜两侧的浓度势能差大于当时阻碍钾离子透出的电势能差。但钾离子移出越多,膜两侧阻止钾离子外移的电场力将越大,最后膜两侧浓度势差和电势差方向相反而大小相等,不再有钾离子的净移动,此时的电位差称为钾离子的平衡电位。
中文名:平衡电位
外文名:equilibrium potential
方法:通过能斯特方程计算
结果:不形成离子移动的膜电位水平
状态:动态平衡并非静止
应用:生物学、化学分析
见载刊物:《生理学名词》 科学出版社
公布时间:1989年
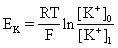 平衡电位式
平衡电位式
把细胞内外某离子的电化学电位等于零时的膜电位,称为该离子的平衡电位。可通过能斯特方程计算,例如钾离子的平衡电位EK可赋予下式:如图式中,0和1分别是钾离子在膜外、内的浓度(确切的说是移动度),F是法拉第常数,T是绝对温度,R是气体常数。哺乳类动物骨胳肌的静息电位是-90mV,离子的平衡电位钠是+66mV,钾是-97mV,氯是-90mV。因为在静息状态下,细胞膜主要对K+、Cl-通透,所以这时的平衡电位近于这些离子的平衡电位;同样,因为在兴奋时细胞膜对Na+容易通透,所以这时的动作电位近于钠离子的平衡电位。
当某离子在浓度梯度的驱动下发生跨膜扩散而引起的扩散电位恰能平衡或对抗其电位差驱使扩散时,即到达电化学平衡时,此扩散电位称为该离子的平衡电位。
如下Fick定律(菲克定律)描述了不带电微粒的简单一维扩散:
式中J——流量;
C——浓度;
x——距离;
D——扩散常数。
如果要描述离子等带电微粒在电压梯度作用下的电扩散,则需要外加一个与电压相关的项。设U为电位,u为微粒的迁移率,z为微粒所带电荷,则整个扩散方程变为
根据斯托克-爱因斯坦方程(Stroke-Einstein%20equation),D与u之间存在如下关系:
D%20=uRT/F
R、T和F分别为是气体常数,绝对温度以及法拉第常数。将此式代入式电扩散的能斯特-普朗克方程(Nernst-Planck%20equation):
平衡状态时,净流量J等于0,于是有:
此式求积分,可得如下能斯特平衡方程:
U1-U2%20=RT/zFln(C1/C2)
分别给定细胞内外某种离子的浓度C1和C2后,就可以用此方程计算跨膜平衡电位(U1-U2)。%20
突触虽然活动,但不产生突触后电位,即不形成离子移动的膜电位水平,称此为突触后电位的平衡电位。突触后电位的大小依赖于静息电位与这种平衡电位之差的大小,如果静息电位远离平衡电位,则突触后电位就大,如果平衡电位是零,静息电位置于平衡电位之上时,则突触后电位的极性发生倒转。平衡电位的存在是化学传递的特征,而化学物质的作用往往是让突触后膜对某种离子的通透性增高;离子的移动,总是力图使膜电位向该离子的平衡电位或由它们的整合作用决定的值,即向突触后电位的平衡电位靠近。就兴奋突触来说,当它传导兴奋时,对Na或Na和K有良好的通透性,平衡电位大都在+20~-20mV之间;就突触后抑制来说,大都对Cl或K或对Cl-和K+具有良好的通透性,平衡电位处于离静息电位数mV、离去极化约20mV的超极化侧之间。%20
金属与电解质溶液构成的体系中,在金属-溶液两相间,当金属离子在两相中的电化学位相等时,就建立起电化学平衡(MMn++ne)。这种单一电极反应的电荷和物质交换均达到了平衡电极电位(φe·M)。它与其溶液中金属本身的离子活度(αMn+)之间的关系符合能斯特公式(Nernst)。
1、由平衡电位确定络离子的配位数
2、由平衡电位判别络离子的反应顺序
如前所述,一个氧化-还原反应可以分两个电极反应表示,将两个电极反应组成原电池,计算原电池的标准电动势E0。
若E0>0,电极反应可以按指定方向自发地进行;
若E0<0,%20电极反应不能按指定方向自发地进行,而是按相反的方向进行。例如
Cu2+%20+Cu←→2Cu+此反应能否自发地自左向右进行?这可把上述反应分成两个电极反应:
电池反应的电动势为-0.368V,小于零,因此,反应不能自发进行。若还原剂相同,可以根据氧化剂的标准电位来判断哪种氧化剂优先反应。
3、金属杂质的电解分离条件
在无超电压时,金属的电沉积服从奈恩斯特方程:
E =E0 +0.059/zlg (伏)
电解液不存在络合剂时,游离金属离子浓度就等于总金属离子的浓度CM。电解液中有络合剂存在时,
=CM/αM (摩尔)
式中,αM称为络合效应系数。且αM =1 +β1 +β22 +β33 +… +βnn。
故 E =E0 -0.059/zlgαM +0.059/zlgCM =E0L +0.059/zlgCM(伏)
E0L为一定络合剂浓度时的条件标准电位。因为αM>o,故E0L比E0值更负。
金属离子要定量地完全被电沉积出来,其浓度至少要下降三个数量级。因此,一般要定量地分离两种金属离子,其沉积电位差至少要达0.2V。若两种金属离子的沉积电位接近,适当地加入合适的络合剂可以增大其电位差。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。





























