-
电解池 编辑
电解池的主要应用用于工业制纯度高的金属,是将电能转化为化学能的一个装置(构成:外加电源,电解质溶液,阴阳电极)。使电流通过电解质溶液或熔融电解质而在阴,阳两极引起还原氧化反应的过程。
中文名:电解池
外文名:Electrolytic cell
主要应用:制纯度高金属氯碱工业防金属腐蚀
构成:外加电源,电解质溶液,阴阳电极
概念:氧化还原反应的过程电解原理
基本概念
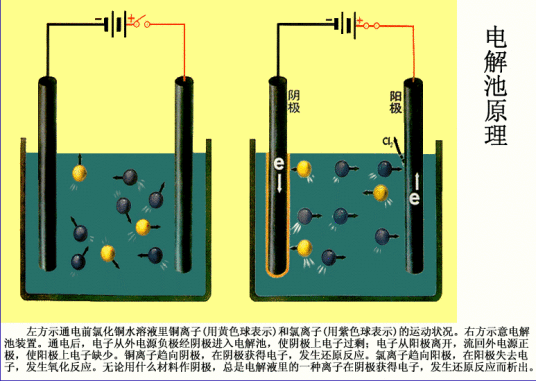
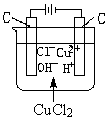 图1 电解池装置
图1 电解池装置
(2)把电能转变为化学能的装置叫做电解池或电解槽。
(3)当离子到达电极时,失去或获得电子,发生氧化还原反应的过程电解原理(电解池装置如图1)
阴极:与电源负极相连的电极。(得电子发生还原反应)
阳极:与电源正极相连的电极。(失电子发生氧化反应)
电解定义
电解是使电流通过电解质溶液(或者是熔融的电解质)
而在阴、阳两极引起还原氧化反应的过程。
图1是电解CuCl2溶液的装置。
通电后发生反应:
阳极:
阴极:
电解过程中的能量转化(装置特点)阴极一定不参与反应不一定是惰性电极;阳极不一定参与反应也不一定是惰性电极
反应条件
①连接直流电源
②阴阳电极%20阴极:与电源负极相连为阴极
阳极:与电源正极相连为阳极
③两极处于电解质溶液或熔融电解质中
④两电极形成闭合回路
电极反应
电极反应与电源的正极相连的电极称为阳极。
物质在阳极上失去电子,发生氧化反应。如图1装置中,Cl-在阳极上失去电子转化为Cl2,
与电源的负极相连的电极成为阴极。物质在阴极上得到电子,发生还原反应。如图1装置中,Cu2+在阴极是得到电子转化为Cu,阴极反应式:
电解结果
在两极上有新物质生成
反应规律
阳极:活泼金属—电极失电子(Au,Pt除外);
惰性电极—溶液中阴离子失电子
失电子能力:活泼金属(除Pt,Au)>S2->I->Br->Cl->OH->含氧酸根(NO3->SO42-)>F-
阴极:溶液中阳离子得电子能力:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+(即金属活动性顺序表的逆向)
规律:铝前(含铝)离子不放电,氢(酸)后离子先放电,氢(酸)前铝后的离子看条件。
四类电解型的电解规律(当阳极为惰性电极时)
①电解水型(强碱,含氧酸,活泼金属的含氧酸盐),pH由溶液的酸碱性决定,溶液呈碱性则pH增大,溶液呈酸性则pH减小,溶液呈中性则pH不变。电解质溶液复原—加适量水。
②电解电解质型(无氧酸,不活泼金属的无氧酸盐),无氧酸pH变大,不活泼金属的无氧酸盐pH不变。电解质溶液复原—加适量电解质。
③放氢生碱型(活泼金属的无氧酸盐),pH变大。电解质溶液复原—加阴离子相同的酸。
④放氧生酸型(不活泼金属的含氧酸盐),pH变小。电解质溶液复原—加阳离子相同的碱或氧化物。
电解意义
使在通常情况下不发生变化的物质发生氧化还原反应,得到所需的化工产品、进行电镀以及冶炼活泼的金属,在金属的保护方面也有一定的用处。
氯碱工业
饱和食盐水溶液中存在
阴极:
阳极:
总反应的化学方程式:
用离子方程式表示:
电镀应用
电镀:应用电解原理在某些金属表面镀上一薄层其他金属或者合金的过程
条件:①镀件做阴极②镀层金属做阳极③电镀液中含镀层金属离子
电镀时,把待镀的金属制品(即镀件)作阴极,镀层金属作阳极,用含有镀层金属离子的溶液作电镀液。
阳极:
阴极:
这样,在直流电的作用下,镀层金属就均匀地覆盖到镀件的表面。同样的道理,用纯铜作阴极,用粗铜作阳极,用CuSO4溶液作电解液。通入直流电,作为阳极的粗铜逐渐溶解,在阴极上析出纯铜,从而达到提纯铜的目的。
金属防护
⑴改变金属的内部组织结构合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。如:不锈钢。
⑵在金属表面覆盖保护层。常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
⑶电化学保护法
①外加电源的阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。
②牺牲阳极的阴极保护法:外加负极材料,构成原电池,被保护的金属作正极。%20
冶炼金属
钠、钙、镁、铝等活泼金属,很难用还原剂从它们的化合物中还原得到单质,因此必须通过电解熔融的化合物的方法得到。如电解熔融的氯化钠可以得到金属钠:
阴极:
阳极:
放电顺序
(1)阳极:与电源的正极相连。
当阳极的电极材料为金属(Pt或Au除外)时,通电后作电极的金属失去电子变成金属离子,溶解到电解质溶液中。
当阳极的电极材料是惰性物质(如Au、Pt或石墨)时,通电后溶液中的阴离子在阳极上失去电子,当溶液中同时存在多种阴离子时,还原性强的离子先失去电子发生氧化反应。
常见阴离子的还原性由强到弱的顺序是:活性电极大于硫离子大于碘离子大于溴离子大于氯离子大于氢氧根离子大于含氧酸根离子(如SO42-、NO3-等)大于氟离子。
Cl-和OH-在电解时的电极反应式分别是:
阳极:
阴极:
(2)阴极:与电源的负极相连。在阴极上发生还原反应的是溶液中的阳离子。
当溶液中存在多种阳离子时,按金属活动性顺序,越不活泼的金属,其阳离子的氧化性越强,越容易被还原。在水溶液中,铝之前的金属的阳离子不可能被还原。
注意事项
1.无氧酸是其本身的电解(HF除外)2.
含氧酸是水的电解3.
可溶性碱是水的电解4.
活泼性金属的含氧酸盐也是水的电解5.
活泼金属的无氧酸盐阴极析出氢气并伴随溶液显碱性,阳极析出非金属单质6.
不活泼金属的无氧酸盐是该盐的电解7.
中等活动性金属的含氧酸盐阴极析出金属,阳极得到氧气同时酸性提高
记忆方法
阳极出氧卤,阴极氢金属。
盐的离子都放电,离子浓度急速减;
盐的离子不放电,水耗离子浓度添。
酸根离子单放电,产物必得卤氢碱;
金属离子单放电,产物必得含氧酸。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。