-
压缩因子 编辑
压缩因子Z是理想气体状态方程用于实际气体时必须考虑的一个校正因子,用以表示实际气体受到压缩后与理想气体受到同样的压力压缩后在体积上的偏差。
校正后的方程,是描述真实气体的性质中,最简单,最直接,最准确,使用的压力范围也最广泛的状态方程。
中文名:压缩因子
外文名:compressibility factor
符号:Z
应用学科:化学、物理
应用领域:实际气体
别名:压缩系数
由于理想气体作了两个近似:忽略气体分子本身的体积和分子间的相互作用力,所以实际气体都会偏离理想气体。偏离的程度取决于气体本身的性质以及温度、压强等因素。一般而言,沸点低的气体在较高温度和较低压强时偏差较小,反之偏差较大。
压缩因子Z被引用来修正理想气体状态方程:
压缩因子的定义式为:
很显然,Z的大小反映出真实气体对理想气体的偏差程度,即Z等Vm(真实)除以Vm(理想)。由于Z反映出真实气体压缩的难易程度,所以将它称为压缩因子。
可以看出,Z是同样条件下真实气体摩尔体积与理想气体摩尔体积的比值,它的大小反映出真实气体偏离理想气体的程度。理想气体的Z值在任何条件下恒为1。Z小于1说明真实气体的摩尔体积比同样条件下理想气体的为小,真实气体比理想气体更易压缩。Z大于1则相反。由于它反映出真实气体的压缩难易程度,所以称为压缩因子。压缩因子的量纲为一。
当Z<1时,说明真实气体的Vm比同样条件下理想气体的Vm小,此时真实气体比理想气体易于压缩,这是因为实际分子内聚力使得气体分子对气壁碰撞产生的压强减小,所以实测的压强比理想状态的压强要小些,p测<p理想。
当Z>1时,说明真实气体的Vm比同样条件下理想气体的Vm大,此时真实气体比理想气体难于压缩,这是因为分子占有一定的空间体积,实测的体积总是大于理想气体的体积,V测>V理想
两种相反的因素相互制约,Z的大小关键看哪一个因素占主导。
用压缩因子表示的维里方程如下:
对p取导数可以看到,真实气体的
此外可以类似地使用
将压缩因子的概念应用于临界点,可以类似地得到“临界压缩因子”:
虽然压缩因子Z表示得是真实气体行为偏离理想状态的程度,但由于理想状态是不存在的,便无实际具体的实验数据,因而难以从压缩因子Z的物理意义上直接求出其数值。%20
临界压缩因子
后实验发现,各个气体在临界状态时偏离理想气体的程度大致相同。当实际气体处于临界点(临界气压Pc,临界温度Tc,临界摩尔体积Vm,c)时,定义此时的压缩因子称为临界压缩因子ZC,将方程改写为
对比参数
为求出其数值Z,找出Z的普遍性规律,科学家思考:为避免气体分子性质的不同而导致压缩因子Z的不同,能否导出一个不具有气体特性常数的方程呢?
随后即引入对比气压Pr,对比温度Tr,对比摩尔体积Vm,r,统称为对比参数。其定义式为:
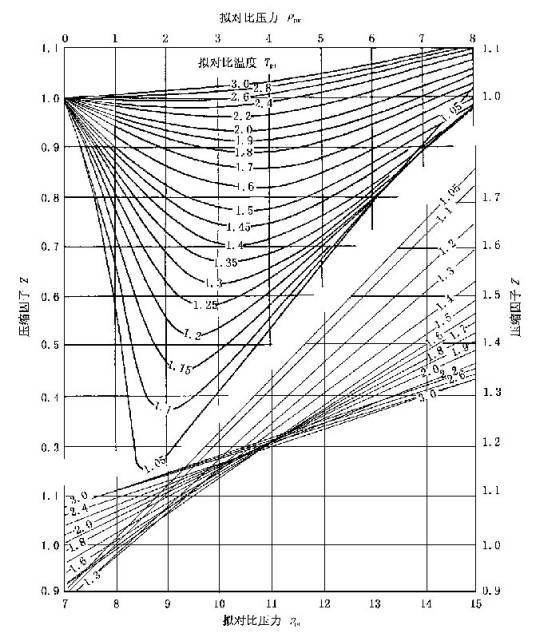
上面的方程式中右方第一项的临界压缩因子Zc数值波动不大,可看作一个常数;而右方第二项三个参数可以根据对比态原理(不同物质如果具有相同的对比压力pr和对比温度Tr,那么对比体积也相同)表示成两个参数的函数式,下面根据这两个参数得出的最为常见压缩因子图。
图形
普遍化压缩因子图
荷根(Hougen)和华特生(Watson)测定了许多气体有机物质和无机物质压缩因子随对比温度Tr和对比压力Pr变化的关系,绘制成曲线,所得关系图称为"普遍化压缩因子图"。见图2。当实际气体的临界压力pc和临界温度Tc的数据为已知,可将某态下的压力p和温度T换算成相应的对比压力pr和对比温度Tr,从图2中找出该对比态下的压缩因子Z。再由下式计算气体的摩尔体积Vm。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。