-
脂质体 编辑
脂质体(Liposomes)是由卵磷脂和神经酰胺等制得的脂质体(空心),具有的双分子层结构与皮肤细胞膜结构相同,对皮肤有优良的保湿作用,尤其是包敷了保湿物质如透明质酸、聚葡糖苷等的脂质体是更优秀的保湿性物质。
中文名:脂质体
外文名:liposome
类别:人工膜
直径:25~1000nm不等
 脂质体
脂质体
脂质体的分类
1.脂质体按照所包含类脂质双分子层的层数不同,分为单室脂质体和多室脂质体。
小单室脂质体(SUV):粒径约0.02~0.08μm;大单室脂质体 (LUV)为单层大泡囊,粒径在0.1~lμm。
多层双分子层的泡囊称为多室脂质体 (MIV),粒径在1~5μm之间。
2.按照结构分:单室脂质体,多室脂质体,多囊脂质体
3.按照电荷分:中性脂质体,负电荷脂质体,正电荷脂质体
4.按照性能分:一般脂质体,特殊功效脂质体
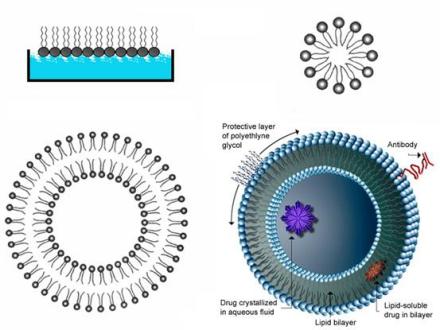
脂质体的组成与结构
 脂质体
脂质体
天然磷脂以卵磷脂(磷脂酰胆碱,PC)为主,来源于蛋黄和大豆,显中性。
合成磷脂主要有DPPC(二棕榈酰磷脂酰胆碱)、DPPE(二棕榈酰磷脂酰乙醇胺)、DSPC(二硬脂酰磷脂酰胆碱)等,其均属氢化磷脂类,具有性质稳定,抗氧化性强,成品稳定等特点,是国外首选的辅料。
2、胆固醇:胆固醇与磷脂是共同构成细胞膜和脂质体的基础物质。胆固醇具有调节膜流动性的作用,故可称为脂质体“流动性缓冲剂”。
1、形态、粒径及其分布
 脂质体
脂质体
2、包封率和载药量
包封率:包封率=(脂质体中包封的药物/脂质体中药物总量)×100%
一般采用葡聚糖凝胶、超速离心法、透析法等分离方法将溶液中游离药物和脂质体分离,分别测定,计算包封率。通常要求脂质体的药物包封率达80%以上。
载药量:载药量=×100%
载药量的大小直接影响到药物的临床应用剂量,故载药量愈大,愈易满足临床需要。载药量与药物的性质有关,通常亲脂性药物或亲水性药物较易制成脂质体。
3、脂质体的稳定性
1)、物理稳定性:主要用渗漏率表示。
渗漏率=(放置前介质中药物量-放置后介质中的药量)/制剂中药量x100%
胆固醇可以加固脂质双分子层膜,降低膜流动,可减小渗漏率。
2)、化学稳定性:
(1)磷脂氧化指数:氧化指数=A233nm/A215nm;一般规定磷脂氧化指数应小于0.2。
(2)磷脂量的测定:基于每个磷脂分子中仅含1个磷原子,采用化学法将样品中磷脂转变为无机磷后测定磷摩尔量(或重量),即可推出磷脂量。
4、防止氧化的措施:
防止氧化的一般措施有充入氮气,添加抗氧剂-生育酚、金属络合剂等;也可直接采用氢化饱和磷脂。
5、脂质体的灭菌:
灭菌的一般方法有过滤除菌、无菌操作、-射线照射(60钴15~20kGy)、121℃热压灭菌等。
1、靶向性和淋巴定向性:肝、脾网状内皮系统的被动靶向性。用于肝寄生虫病、利什曼病等单核-巨噬细胞系统疾病的防治。如肝利什曼原虫药锑酸葡胺脂质体,其肝中浓度比普通制剂提高了200~700倍。
2、缓释作用:缓慢释放,延缓肾排泄和代谢,从而延长作用时间。
3、降低药物毒性:如两性霉素B脂质体可降低心脏毒性。
4、提高稳定性:如胰岛素脂质体、疫苗等可提高主药的稳定性。
注入法、薄膜分散法、超声波分散法、逆向蒸发法。
脂质体作为药物载体的临床应用
 脂质体
脂质体
2、抗寄生虫药物载体:苯硫咪唑脂质体和阿苯达唑脂质体等。利用脂质体的被动靶向性,提高药物的生物利用度,减少用量,降低毒副作用。
3、抗菌药物载体:庆大霉素脂质体和两性霉素B,可减少药物的耐药性,降低心脏毒性。
4、激素类药物载体。
给药途径
 脂质体
脂质体
体内过程
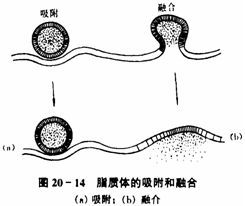
脂质体与细胞之间作用的主要形式包括膜间转运(细胞膜的脂质交换)、接触释药、吸附、融合和内吞。
脂质体具有类细胞结构,进入体内主要被网状内皮系统吞噬而激活机体自身的免疫功能,并改变包封药物的体内分布,使药物主要在肝、脾、肺和骨髓等组织器官中积蓄,从而提高药物的治疗指数、减少药物的治疗剂量和降低药物的毒性。
新型靶向脂质体
 脂质体
脂质体
直接影响脂质体的大小和均匀性。前体脂质体可预防脂质体之间相互聚集,且更适合包封脂溶性药物。
2、长循环脂质体: 经过PEG修饰,以增加脂质体的柔顺性和亲水性,通过单核-巨噬细胞系统吞噬,减少脂质体脂膜与血浆蛋白的相互作用,延长循环时间,称为长循环脂质体
(long-circulating liposome)。长循环脂质体有利于肝脾以外的组织或器官的靶向作用。同时,将抗体或配体结合在PEG的末端,既可保持长循环,
又可保持对靶体的识别。
3、免疫脂质体:脂质体表面联接抗体,对靶细胞进行识别,提高脂质体的靶向性。如在丝裂霉素(MMC)脂质体上结合抗胃癌细胞表面抗原的单克隆抗体3G 制成免疫脂质,在
体内该免疫脂质体对胃癌靶细胞的M85杀伤作用比游离MMC提高4倍。
4、热敏脂质体:利用在相变温度时,脂质体的类脂质双分子层膜从胶态过渡到液晶态,脂质膜的通透性增加,药物释放速度增大的原理制成热敏脂质体。例如将二棕榈酸磷脂
(DPPC)和二硬脂酸磷脂(DSPC)按一定比例混合,制成的3H甲氨喋呤热敏脂质体,再注入荷Lewis肺癌小鼠的尾静脉后,再用微波加热肿瘤部位至42℃,病灶部位
 脂质体
脂质体
位时,由于pH的降低导致脂肪酸羧基脂质化成六方晶相的非相层结构,从而使膜融合,加速释药。
总之,脂质体作为药物载体是临床应用较早,发展最为成熟的一类新型靶向制剂。美国FDA批准上市的脂质体产品有两性霉素B、阿霉素脂质体。批准进入临床试验的脂
质体有丁胺卡钠霉素。未来脂质体的研究主要集中在以下三个方面:
1、膜结构与载药性质之间的关系;
2、脂质体在体内的靶向特性;
3、在体外培养中将基因和其他物质导入细胞内有望成为基因药物载体。
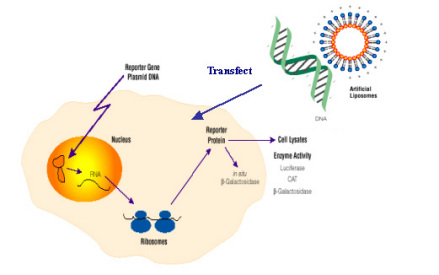
脂质体是由脂双分子层组成的颗粒,可介导基因穿过细胞膜。通过脂质体介导比利用病毒转导进行基因转移具有以下明显的优势:①脂质体与基因的复合过程比较容易;②易于大量生产;③脂质体是非病毒性载体,与细胞膜融合将目的基因导入细胞后,脂质即被降解,无毒,无免疫原性;④DNA或RNA可得到保护,不被灭活或被核酸酶降解;⑤脂质体携带的基因可能转运至特定部位;⑥体外和体内试验都表明,接近染色体大小的DNA片段也能被转运至宿主基因组中并增长;⑦转染过程方便易行,重现性好。
脂质体是具有双层膜的封闭式粒子,自身聚集性脂类分子包封内水相介质,可分为大、小多层,寡多层和单室脂质体,医学应用较多为小单室脂质体。基于脂质体作为药物载体系统的经验,理想的用于转运基因的脂质体,对于质粒DNA具有高包封率,保护DNA不被血浆核酶降解的特点,它们粒径分布范围窄,粒径平均为100 nm或者更小。为使脂质体接近血管外区域,故采用具有广泛的结合潜力脂类,这种特殊脂类可促进与细胞膜融合和/或提高脂质体在循环系统中的稳定性。第1种为传统上的脂质体,人们可控制其体外行为,但不能控制其体内行为,它们很快被灭活或被固定;第2种为无活性脂质体(即不与外界作用),由于聚合物包封于表面的立体稳定性而抑制其相互作用;第3种脂质体表面结合抗原、凝集素或其他基团,由于表面结合的特定配基,也可特定地相互作用;第4种为反应活性脂质体,如离子型、靶敏感型和融合性脂质体,这种脂质体有时指相转变的多孔脂质体,脂质体内有离子敏感亚基,Ca2+ 其他金属离子敏感性脂质体,也包括阳离子脂质体,阴离子脂质体。阴离子脂质体不属于有反应活性类,但特殊的试验如试管内与相反电荷(多)离子相互作用例子除外。
常规脂质体进入细胞转运DNA实验,其原理是脂质体增强细胞体的聚集,即加速大分子、荷电多的分子透过膜,该过程相当复杂,尤其在包封较大片段时,在实践中这种技术只在体外使用且要用融合剂,荷电越多用途越少。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。