-
β折叠 编辑
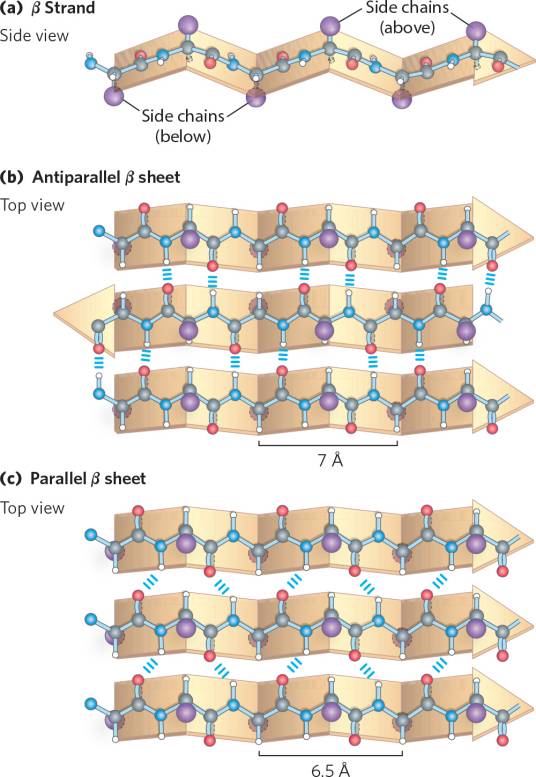
是蛋白质的二级结构,肽键平面折叠成锯齿状,相邻肽链主链的N-H和C=O之间形成有规则的氢键,在β-折叠中,所有的肽键都参与链间氢键的形成,氢键与β-折叠的长轴呈垂直关系。β折叠(概述图):
β折叠层并不是平的,因为侧链的存在使得它看上去像手风琴一样波纹起伏。这样每一股会更紧密排列,氢键更容易建立。氢键的距离为7埃。在蛋白质结构中beta-折叠通常会用箭头表示。肽链的氮端在同侧为顺式,两残基间距为0.65nm;不在同侧为反式,两残基间距为0.70nm。反式较顺式平行肽链更加稳定。能形成β折叠的胺基酸残基一般不大,而且不带同种电荷,这样有利于多肽链的伸展,如甘氨酸、丙氨酸在β折叠中出现的几率最高。免疫球蛋白有大量的Β-肽链层。
另一种常见的蛋白质模序是alpha-螺旋和三种不同的β-转角。不属于一个模序的蛋白质一级结构部分被称之为不规则螺旋。这些部分对蛋白质的空间构象非常重要。
结构要点
1. 肽链呈锯齿状,按层排列,可以是不同的肽链,也可以是同一条肽链的不同肽段。
2. 相邻肽链的C=O与N—H间形成氢键,氢键与长轴垂直。
3. 相邻肽链平行或反平行排列,反平行的更稳定。也存在平行与反平行混合出现的结构,约占20%。
4. 一个残基占0.325nm(平行式)或0.35nm(反平行式)。
影响稳定因素
1. 靠键间氢键维持稳定。
2. 氨基酸Pro破坏之。
3. 侧链过大,带同种电荷侧链基团相邻时均影响β折叠片的稳定性。
平行与反平行
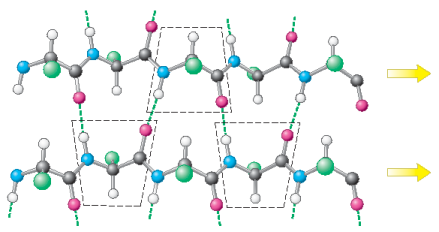 平行的肽链
平行的肽链
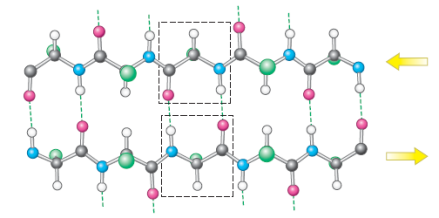 反平行的肽链
反平行的肽链
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。