-
离子键 编辑
离子键通过两个或多个原子或化学基团失去或获得电子而成为离子后形成。带相反电荷的离子之间存在静电作用,当两个带相反电荷的离子靠近时, 表现为相互吸引,而电子和电子、原子核与原子核之间又存在着静电排斥作用,当静电吸引与静电排斥作用达到平衡时,便形成离子键。因此,离子键是指阴离子,阳离子间通过静电作用形成的化学键。离子键属于化学键,大多数的盐,由碱金属或碱土金属形成的键,活泼金属氧化物都有离子键。含有离子键的化合物称为离子化合物。离子键与物体的熔沸点和硬度有关。
此类化学键往往在金属与非金属间形成。失去电子的往往是金属元素的原子,而获得电子的往往是非金属元素的原子。带有相反电荷的离子因电磁力而相互吸引,从而形成化学键。离子键较氢键强,其强度与共价键接近。
成键微粒:阴离子和阳离子 ;
键的本质:阴离子和阳离子之间的静电作用;
影响因素:阴阳离子的半径的大小半径越大离子键越小;阴阳离子电荷的多少 ;
电子式:在元素符号周围用“· ”或“×”来表示原子最外层电子的式子 。
性质
离子键的作用力强,无饱和性,无方向性。
离子键存在于离子化合物中,离子化合物在室温下是以晶体形式存在。
离子键较氢键强,其强度与共价键接近。
阴阳离子是否中和
也许有人会问,阴阳离子结合在一起,彼此电荷是否中和呢?钠离子和氯离子之间除了有静电相互吸引作用外,还有电子与电子,原子核与原子核之间的相互排斥作用。当两种离子接近到某一定距离时,吸引与排斥达到了平衡,于是阴阳离子之间就形成了稳定的化学键。所以,所谓阴阳离子电荷相互中和的现象是不会发生的。
晶格能
离子键的键能比较大,反映在离子化合物中就是高熔沸点,离子键的键能被称作晶格能,晶格能的符号与离子晶体解离过程焓变的符号保持一致 。晶格能可以通过玻恩-哈勃循环(Bōrn-Haber cycle)或玻恩-兰德公式(Bōrn-Landé)计算得出,也可以通过实验测量测量 。
以下是通过玻恩-哈勃循环(Bōrn-Haber cycle)计算得出的晶格能数据,单位:千焦/摩
类型 | NaF | NaCl | NaBr | NaI | KF | KCl | KBr | KI | BeO |
晶格能 | 923 | 786 | 747 | 704 | 812 | 715 | 730 | 649 | 4443 |
类型 | MgO | CaO | SrO | BaO | |||||
晶格能 | 3791 | 3401 | 3223 | 3054 |
注:计算所需参数(升华焓、电离能、汽化热、键能、电子亲和能)数据均取自《无机化学(第五版)》,2006 .
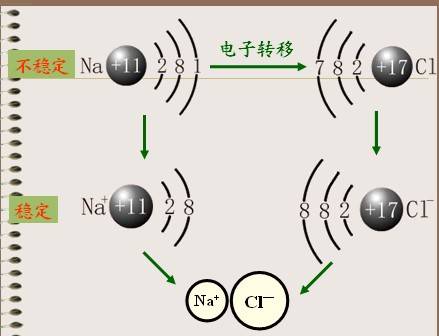
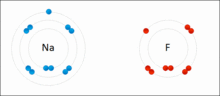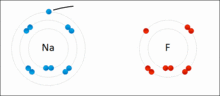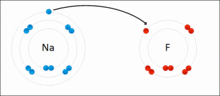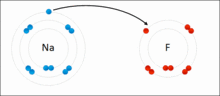 离子键的形成示意图
离子键的形成示意图
而在现实中,原子间并不形成“纯”离子键。所有的键都或多或少带有共价键的成分。成键原子之间电平均程度越高,离子键成分越低。成键原子之间电负性差异越大,键的极性越大,当差值足够大时,就可以假定“共用”的电子变成了电负性较大的原子的“所有物”。%20换句话说,就是电子从一个原子转移到另一个原子,也就是形成了离子键。
离子键的结合力很大,因此离子晶体的硬度高,强度大,热膨胀系数小,但脆性大。离子键很难产生可以自由运动的电子,所以离子晶体都是良好的绝缘体,但在熔融或溶液状态下,离子键会发生电离,产生游离的正负离子,此时可以导电。在离子键结合中,由于离子的外层电子比较牢固的被束缚,可见光的能量一般不足以使其受激发,因而不吸收可见光,所以典型的离子晶体是无色透明的。Al2O3、MgO、TiO2、NaCl等化合物都是离子键。%20
研究认为,在分子或晶体中的原子决不是简单地堆砌在一起,而是存在着强烈的相互作用。化学上把这种分子或晶体中原子间(有时原子得失电子转变成离子)的强烈作用力叫做化学键。键的实质是一种力。所以有的又叫键力,或就叫键。
以钠与氯化合生成氯化钠为例:
从原子结构看,钠原子最外电子层上有1个电子,容易失去;氯原子在外电子层有7个电子容易得到一个电子。当钠原子与氯原子相遇时,钠原子失去最外层的一个电子,成为钠离子,带正电,氯原子得到钠失去的电子,成为带负电的氯离子,阴阳离子的异性电荷的吸引作用,与原子核之间、电子之间的排斥作用达到平衡,形成了稳定的离子键。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。